时间: 2024-05-11 09:14:15 | 作者: 注塑加工
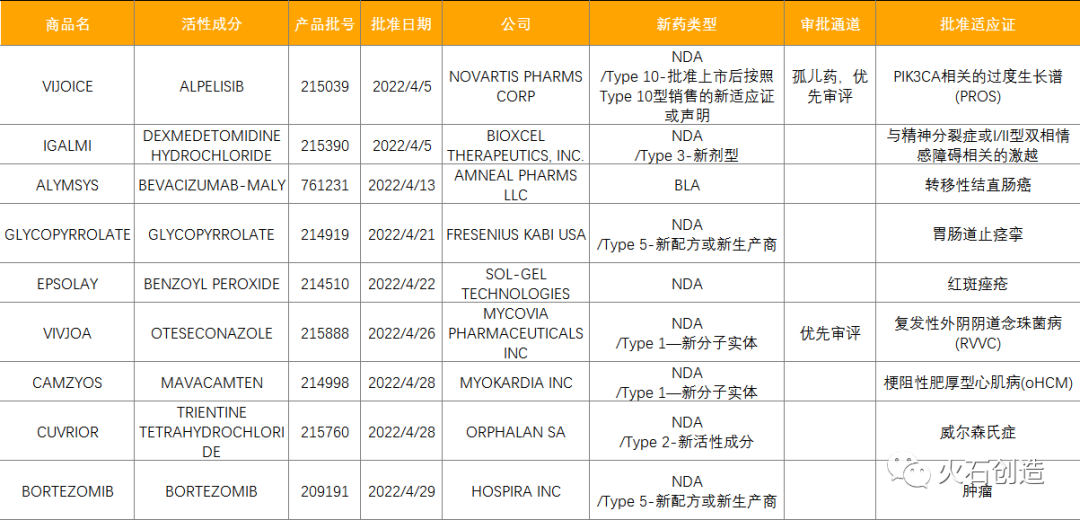
2022年4月,全球仍稳速批准新药上市。FDA批准9款新药(NDA/BLA),包含2款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),1款生物制品药物(BLA);EMA新授权4款药品上市,其中Kimmtrak开创了全球首款T细胞受体(TCR)疗法;NMPA批准4个品规(2个品种)创新药上市,均为化药,其中山东罗欣的替戈拉生片是国内首款钾离子竞争性酸阻滞剂(P-CAB),属于国家“重大新药创制”科技重大专项支持研发的高科技成果。
医疗器械方面,FDA有2个通过上市前批准(PMA)途径首次上市的产品。境内批准了6个创新器械上市,国内医疗器械审批集中在注输、护理和防护器械,共765项,占28.36%。

图1:2010—2022年4月FDA药物批准数量变动情况数据来源:美国食品药品监督管理局
如图1,截至2022年5月5日FDA官网披露,2022年4月FDA共完成44项药品首次批准(不包含暂时批准),其中NDA/BLA批准9款(不包含暂时批准),见表1。这中间还包括2款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),1款生物制品药物(BLA)。
其中VIJOICE是FDA批准的第一种治疗PIK3CA相关过度生长谱(PROS)疾病的药物,PROS 是一系列罕见疾病,其特点是血管、淋巴系统和其他组织的非典型过度生长和异常;IGALMI(Dexmedetomidine,右美托咪定)是FDA批准治疗精神分裂症或I/II型双相情感障碍相关的激越患者群体的首款口溶舌下膜剂,能迅速起效,是近十年来第一个治疗该类病症的新急性疗法,代表着一种帮助患者控制症状的差异化疗法;VIVJOA是FDA批准的第一个也是唯一一个针对复发性外阴念珠菌病的药物,为一款新型的线口服抑制剂。
百时美施贵宝(BMS)旗下全资子公司MYOKARDIA INC申报的CAMZYOS是首个且唯一一个获得FDA批准的心肌肌球蛋白别构可逆性抑制剂。
联拓生物于2020年8月11日与MYOKARDIA达成授权引进合作,在中国大陆、香港、澳门、台湾、泰国和新加坡对CAMZYOS进行开发和商业化,交易总金额达1.875亿美元,该药(CDE申报名:Mavacamten胶囊)于2022年2月7日获CDE纳入突破性治疗品种。
截至2022年5月5日EMA官网披露,2012年至2022年4月的推荐上市药品及新活性物质(NAS)数量情况见图2。2022年4月EMA未推荐药品上市。

图2:2012—2022年4月EMA推荐上市药品数量变动情况数据来源:火石创造数据库
其中Kimmtrak是全球首款T细胞受体(TCR)双特异性免疫疗法、第一个也是唯一一个用来医治不可切除性或转移性葡萄膜黑色素瘤患者的疗法,曾于2022年1月25日获得FDA批准上市;Breyanzi是百时美施贵宝(BMS)在欧盟获批的第二款CAR-T细胞疗法,第一款为2021年8月18日获批上市、用来医治多发性骨髓瘤的Abecma;Kapruvia是欧洲第一个用于血液透析病人治疗慢性肾脏病相关瘙痒(CKD-aP)的疗法,其活性成分difelikefalin是一种首创(first-in-class)KOR激动剂,作用于人体外周神经系统和某些免疫细胞。
截至2022年5月5日NMPA披露,2022年4月共批准国产首次注册药品52件。按剂型去重后,共40个药品品种(不同厂家生产同一药物按同一品种计算)。本月有4个品规(2个品种)1类创新药获批,均为化药。2022年4月NMPA批准的1类创新药情况见表3。

替戈拉生片(泰欣赞),是山东罗欣药业持有及生产的国内首款钾离子竞争性酸阻滞剂(P-CAB),属于国家“重大新药创制”科技重大专项支持研发的高科技成果。该产品2019年在韩国上市,是全世界内已获批上市的四款P-CAB类药物之一,罗欣药业曾于2015年与韩国HK inno.N Corporation达成合作协议,获得替戈拉生片在中国境内独家研发、生产及商业化权益。此次国内上市为治疗反流性食管炎、改善患者的生活品质带来全新的用药选择。
阿布昔替尼片(希必可/CIBINQO),是辉瑞公司研发的Janus激酶(JAK)1抑制剂。该药是NMPA批准上市的第5款JAK抑制剂,也是辉瑞的第2款,第1款为2018年获批上市的枸橼酸托法替布片。其上市为特应性皮炎患者提供了新的治疗选择。
截至2022年5月5日CDE官网披露,CDE共承办药品一致性评价受理号3757个,2022年4月无新增承办受理号。截至2022年5月5日,共4042个品规上市药品通过一致性评价(包含视同通过1601个品规),本月共91个品规的药品通过一致性评价(包含视同通过14个品规),按剂型去重后,共57个药品品种。
目前一致性评价品种通过的注射剂共 1380个品规(214个品种),本月过评药品计53个品规(31个品种)的注射剂。2018年至2022年4月通过一致性评价数量见图3。

图3:2018年至2022年4月仿制药一致性评价批准数量变动情况数据来源:国家药品监督管理总局
截至2022年5月6日,4月FDA共批准256个510(k)途径的产品,其中一类器械21个,二类器械228个,未分类7个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,4月产品获批类型最多的为放射科器械、一般医院和个人使用类器械、一般和整形手术器械、心血管器械与骨科器械,见图4。
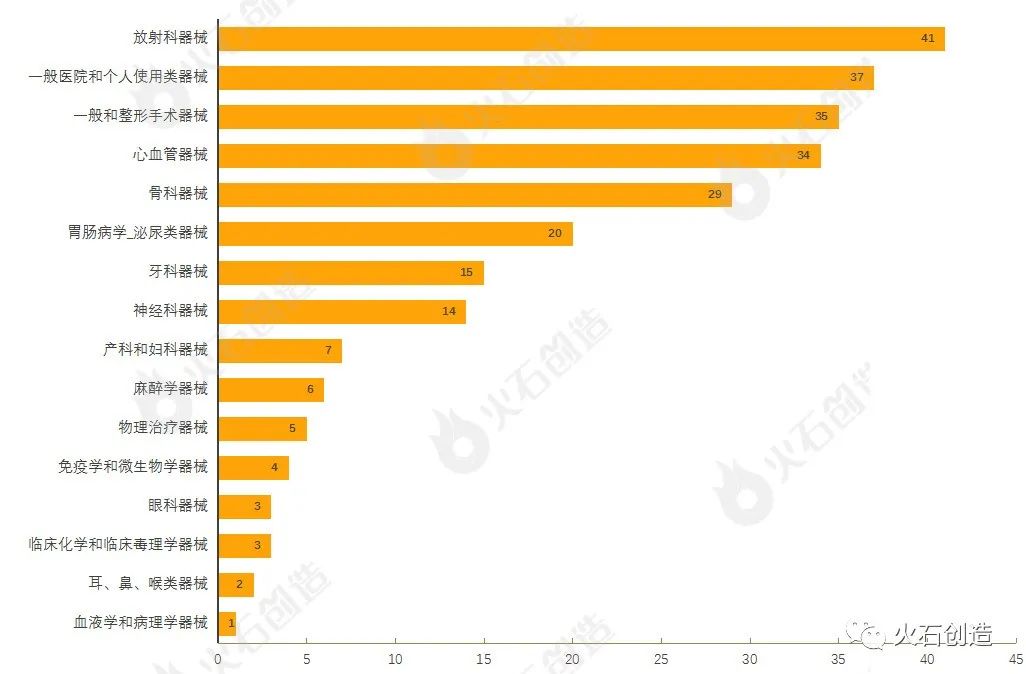
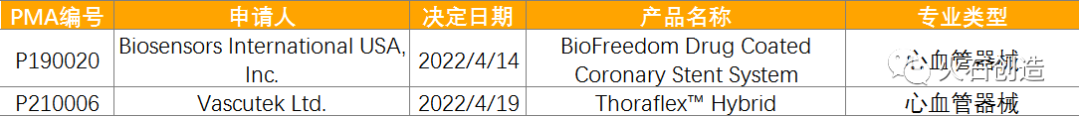
510(k)途径获批上市产品类型分布情况数据来源:美国食品药品监督管理局 2022年4月有2个通过上市前批准(PMA)途径首次上市的产品。
截至2022年5月6日,2022年4月国家局没有公示医疗器械进入创新审批绿色通道。
截至2022年5月6日,2022年4月国家局公示了6个三类创新器械获批上市,见表5。
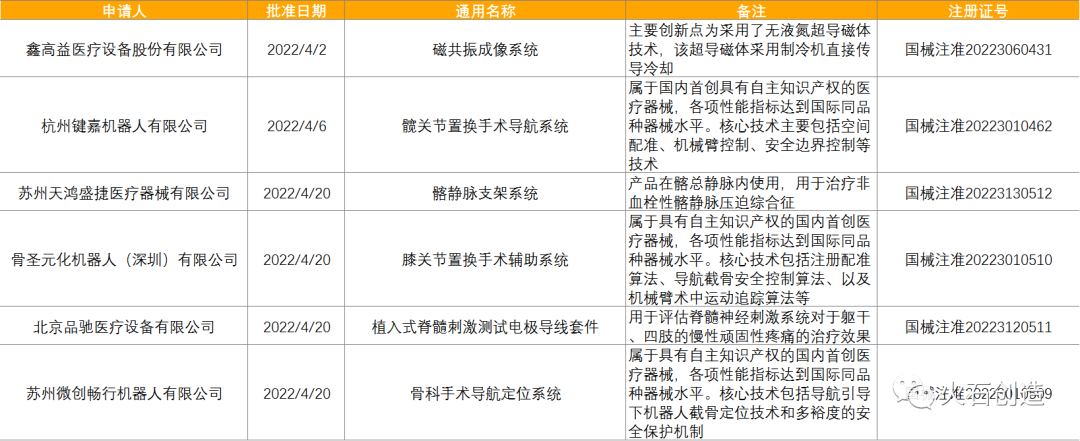
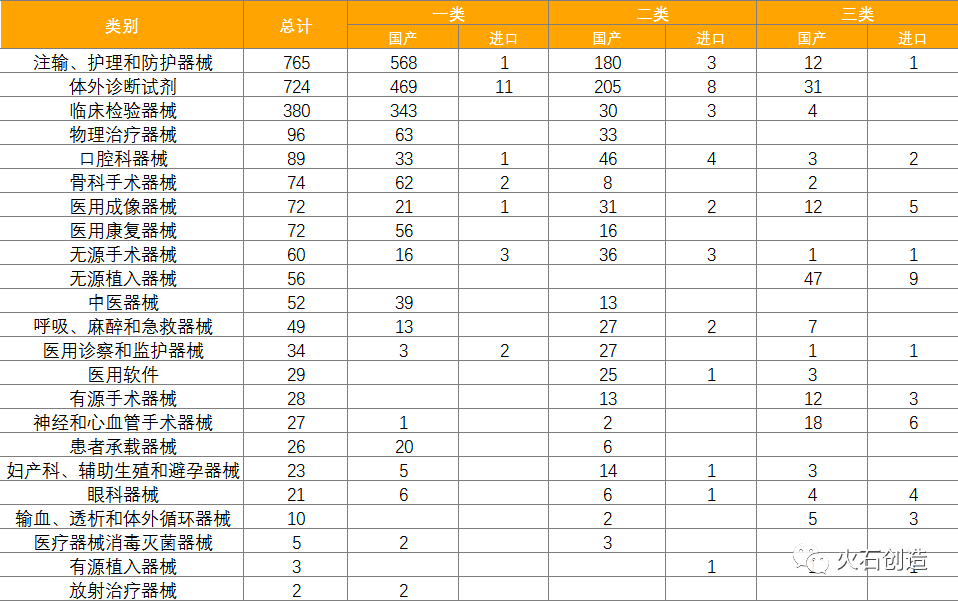
截至2022年5月6日,2022年4月国家局共批准首次注册三类医疗器械产品202个,其中国产166个,进口36个。各省级药品监管部门4月共批准国产第二类医疗器械注册723个,一类备案医疗器械1722个。 统计多个方面数据显示,注输、护理和防护器械最多,共765项,占28.36%,基本上均为国产,为760项。除注输、护理和防护器械,批准注册类别数量排前三位的分别为体外诊断试剂,临床检验器械和物理治疗器械。
从地域分布上,2022年4月国产二、三类注册产品批件最多的依次为江苏省(153件)、广东省(151件)、湖南省(130件)三个区域,见图5。

心血管健康治疗新突破:Alleima Medical合瑞迈医疗浅谈精密导线医药研发百强榜,与背后的秘密



