时间: 2024-05-11 09:14:24 | 作者: 注塑加工
医疗器械方面,FDA有2个经过上市前同意(PMA)途径初次上市的产品。境内同意了6个立异器械上市,国内医疗器械批阅会集在注输、护理和防护器械,共765项,占28.36%。
到2022年5月6日,4月FDA共同意256个510(k)途径的产品,其间一类器械21个,二类器械228个,未分类7个。
经过对510(k)上市前告诉的器械依据美国医学专业用处进行分类,成果发现,4月产品获批类型最多的为放射科器械、一般医院和个人运用类器械、一般和整形手术器械、心血管器械与骨科器械,见图1。
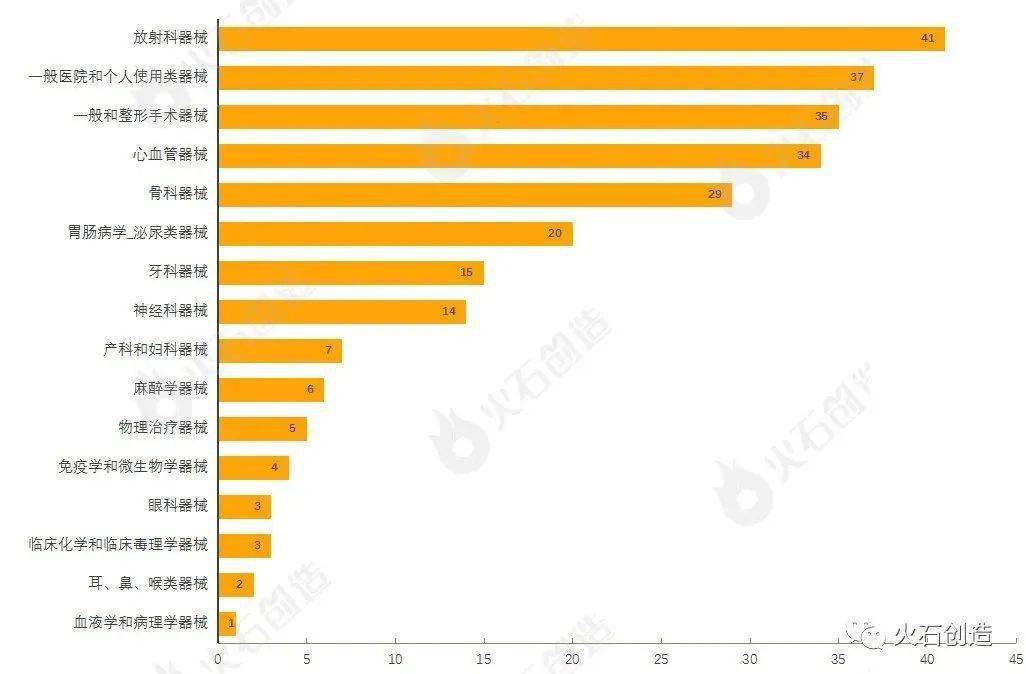
图1 :2022年4月经过FDA 510(k)途径获批上市产品类型散布状况
到2022年5月6日,2022年4月国家局没有公示医疗器械进入立异批阅绿色通道。
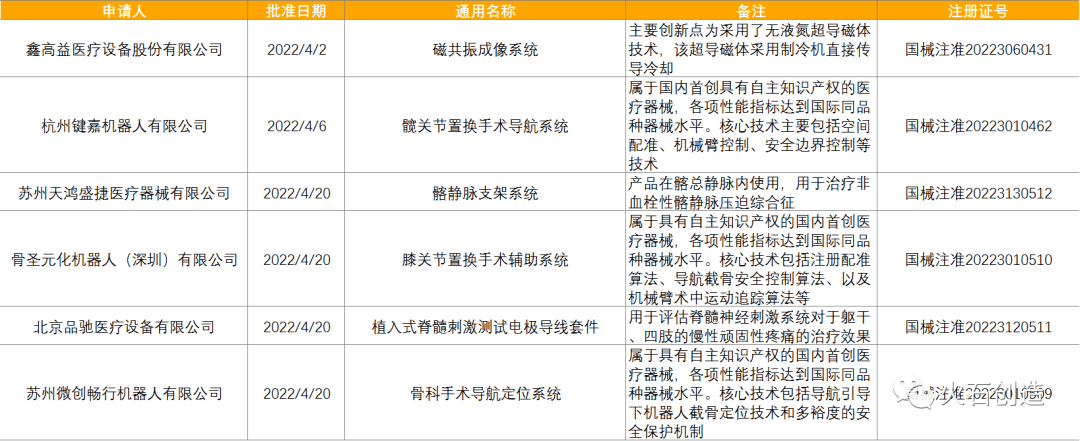
到2022年5月6日,2022年4月国家局公示了6个三类立异器械获批上市,见表2。
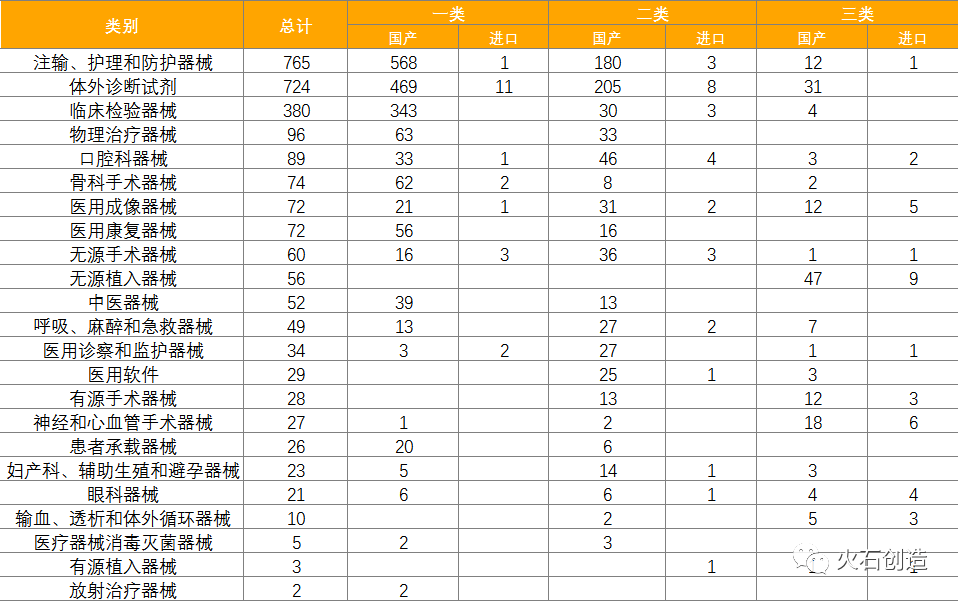
到2022年5月6日,2022年4月国家局共同意初次注册三类医疗器械产品202个,其间国产166个,进口36个。各省级药品监管部门4月共同意国产第二类医疗器械注册723个,一类存案医疗器械1722个。
计算多个方面数据显现,注输、护理和防护器械最多,共765项,占28.36%,基本上均为国产,为760项。除注输、护理和防护器械,同意注册类别数量排前三位的分别为体外确诊试剂,临床查验器械和物理医治器械。
从地域散布上,2022年4月国产二、三类注册产品批件最多的依次为江苏省(153件)、广东省(151件)、湖南省(130件)三个区域,见图2。



